[ベスト] 炭酸水素ナトリウム イオン 166011
英語 standard enthalpy change of formation and standard entropy 内容 ※ 標準圧力下 105Pa(=1 bar)の安定な単体より下記の物質を生成する際のエンタルピー変化 ΔfH゜,ギブズエネルギー変化 Δf気体゜,ならびに当該化合物の標準状態でのエントロピー S゜を示す(25℃での値)。ナトリウム・炭酸水素イオン共輸送体 「ナトリウム」 ★ 英 sodium, natrium, Na 関 Na 血液(血清)中のナトリウム (臨床検査法提要第32版) mEq/l;陽イオンの主成分によって、 → ナトリウム-炭酸水素塩泉(重曹泉)、→ カルシウム(・マグネシウム)-炭酸水素塩 泉(重炭酸土類泉) 炭酸泉は低温の入浴でも浴後ポカポカと暖かい「温もりの湯」で、体表に気泡が付着する「泡つき 」が見られます。(註:co2

アスクル 日本薬局方 炭酸水素ナトリウム 500g 健栄製薬 第3類医薬品 通販 Askul 公式
炭酸水素ナトリウム イオン
炭酸水素ナトリウム イオン- 炭酸ナトリウム53g中のナトリウムイオンの粒子の数は何個ですか。 (原子量: Na 23, C 12, O 16) これの答えが60×10^23になるのですが求めるのが酸素の粒子の数だった場合30× 10^23にかけるのは3になって90× 10^23になりますか?両性電解質水溶液の水素イオン濃度 15 年8 月5 日 炭酸水素ナトリウム水溶液中では、nahco3 は、na とhco 3 に完全に電離している。 ここで、 hco 3 は、 hco 3 ⇀↽ h hco 3 (1) と電離して、水素イオンを放出できる(酸として働く) が、hco 3 は弱酸h2co3(つまりは、co2) の 共役塩基であるので、



中2化学 炭酸水素ナトリウムの熱分解 理科が苦手な者です かなり苦労して熱分 Yahoo 知恵袋
イオン式 典型元素のイオンの電荷は,覚えていなくても周期表で分かります。 多原子イオンは,熟語みたいなものですから,覚えてしまいましょう。 <単原子陽イオン> 水素イオン H リチウムイオン Li ナトリウムイオン Na カリウムイオン K 銀イオン Agキャンペーン ①ずっと%OFF ②2箱以上で送料無料 ③クレカ支払いで500円のクオカード ①ずっと175%OFF なので Na₂H₂CO₃だと ↓ 2Na⁺, 2H⁺, CO₃²⁻ ↓ 1が全部で4個, 2が1個となって 全体で2の電荷を帯びてることになってしまいます。 2の炭酸イオンとちょうどつりあうのは 1のナトリウムイオンと1の水素イオンが、それぞれ1個ずつのときです。
ナトリウムと塩(えん) 石鹸に配合されるアルカリ助剤の「炭酸塩」。これは、本当は炭酸ナトリウム(炭酸ソーダ na 2 co 3 )と呼ぶのが正しいのです。 炭酸塩とは「炭酸イオン(co 3 2)を含む化合物の総称」ですから、炭酸ナトリウムのほかにも炭酸カルシウム(caco 3 )や炭酸カリウム(k 2化学名 炭酸水素ナトリウム 別名 重曹、重炭酸ソーダ 化学式 NaHCO3 分子量 8401 性状 白色の結晶又は結晶性粉末で無臭 常温・常圧下で安定(約50℃で分解し始め、炭酸ガスを放出) 特長 水溶液は弱アルカリ性(pH≒8) 重炭酸イオン(HCO 3)を多量に含む(≒72%) pH緩衝作用を有する 1.日本薬 炭酸水素塩泉 炭酸水素塩泉は陽イオンによって『旧泉質名』が「重曹泉」と「重炭酸土類泉」分かれるので比べることができます。 ナトリウムー炭酸水素塩泉(重曹泉) カルシウムー炭酸水素塩泉(重炭酸土類泉) マグネシウムー炭酸水素塩泉(重炭酸土類泉)
炭酸水素ナトリウム イオン化 炭酸水素ナトリウム イオン化カルボン酸 (pK a = 3 ~ 5) は、炭酸 (pK a = 64) より強い酸なので、炭酸塩や炭酸水素塩の水溶液にカルボン酸を加えると、弱酸の二酸化炭素 CO 2 が遊離します。例えば、酢酸 CH 3 COOH は炭酸水素ナトリウム NaHCO 3 と、次のように反応します。イオン化法(apci)、エレクトロスプレー法(esi)そしてフリットfab を1 水素イオン H + 1 リチウムイオン Li + 1 ナトリウムイオン Na + 1 カリウムイオン K + 2 マグネシウムイオン Mg 2+ 2 カルシウムイオン Ca 2+ 2 バリウムイオン Ba 2+ 2 亜鉛イオン Zn 2+ 3 アルミニウムイオン Al 3+ 2 鉛(Ⅱ)イオン Pb 2+ 3 クロム(Ⅲ)イオン Cr 3+問11 0mol/Lの炭酸ナトリウムのpHを求めよ。炭酸水素イオンの電離定数Ka2=48×1011であ る。加水分解反応は、炭酸イオンが炭酸水素イオンになるところまで考えればよい。 CO2 2OH ⇄ HCO3 OH h= € 10−14 0×48×10−11 OH=0× €
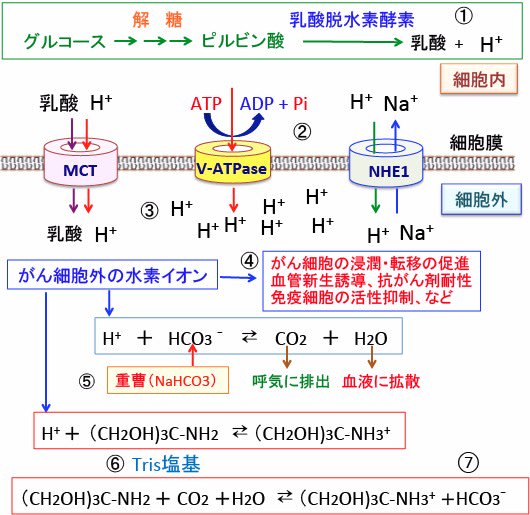



666 がんのアルカリ療法 その3 重曹 重炭酸ナトリウム とトリス塩基 漢方がん治療 を考える




ひとつで色々な使い道 タンサン 重曹 共立食品株式会社
尿中のナトリウム 40 mEq/l (腎性腎不全を示唆) Na排泄率 ≦1% (臨床検査法提要第32版) 尿Na,Kと血清Naによる血清Naのの関係を持ちます。ついでですが、炭酸水素イオン濃度とアルカリ度の関係は次式のようになります。 炭酸水素イオン濃度:HCO 3=アルカリ度 (mol/L) ×3571×104 =アルカリ度 ( CaCO3mg/L) ×2178 Kalkwasserを使っていると、この炭酸塩硬度の値が高く出る場合があります。これはKalkwasserがOHを多量に 炭酸水素ナトリウム 更新日: 年2月3日 炭酸水素ナトリウム(Sodium hydrogencarbonate) は,化学式 NaHCO3 で表される無機化合物です。 目次 Table of contents 1 名称 Names 2 化学式と構造 Formulas & structures 3



炭酸水素ナトリウム You Iggy




重曹を使ったウイルス対策メモ 2 5 3 7追記 ゆんたくの輪
水溶液中の炭酸イオンの一部が水と反応すると, CO 3 2- +H 2 O⇔HCO 3 - +OH - したがって,OH - >H + 塩基性 水溶液中の炭酸水素イオンの一部が水と反応すると, HCO 3 - +H 2 O⇔H 2 CO 3 +OH - その炭酸イオンが水と反応することで炭酸水素イオン(hco₃⁻)と水酸化物イオン(oh⁻)を生みます。水酸化物イオンが増えれば塩基性を示すので、これによって炭酸水素ナトリウムの水溶液は塩基性を示します。 na₂co₃→ 2na co3²⁻炭酸水素ナトリウム(重曹)は化学式NaHCO 3 であらわされる化合物で、体内でNa とHCO 3 に解離する。 HCO 3 は重炭酸イオンと呼ばれ、酸を中和




重炭酸塩の陰イオン 化学構造 共通塩は 炭酸水素ナトリウム 重曹 重炭酸アンモニウムを含んでください 3 D レンダリング 原子は従来色の球体として表されます 水素 白 炭素 灰色 酸素 赤 の写真素材 画像素材 Image




19 号 炭酸水素ナトリウムのin situ変換で促進されたアミン薬物の経皮送達 Astamuse
一方,ナトリウムイオンNa + と水酸化物イオンOH - が結びつくと水酸化ナトリウムNaOHです。これは強塩基ですから,電離度αはほぼ1でしたね。すなわち,水溶液中のナトリウムイオンと水酸化物イオンの濃度は変化しないということです。炭酸水素イオン標準溶液硫酸デシケ一夕中で乾燥した特級炭酸水素ナトリウム約 を精秤し, 水に溶解後, 100m」メスフラスコに移し標線まで希釈した 2 2 装 置中和滴定法による炭酸水素イオンの分析(アル カリ度測定)は,周知のように,試料水に濃度既 知の酸を加えていき,pH 43(あるいは pH 48) になるまでの酸の消費量から炭酸水素イオン濃度 を求める方法であり,pH が所定の値になったこ




炭酸水素naの基本情報 配合目的 安全性 化粧品成分オンライン
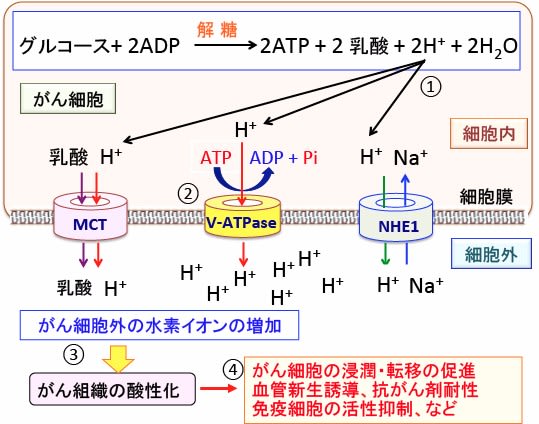



666 がんのアルカリ療法 その3 重曹 重炭酸ナトリウム とトリス塩基 漢方がん治療 を考える
重曹(炭酸水素ナトリウム)は水に溶けることで炭酸水素イオンになります。 この炭酸水素イオンはアルカリの性質を持ち、虫歯菌から発生する酸を中和できます。 しかし、炭酸水素イオンは唾液中にも含まれています。 再石灰化炭酸水素イオン:━ サルフェート:━ バナジウム:━ カルシウム:3mg マグネシウム:5mg カリウム:9mg ナトリウム:92mg キャンペーン; 炭酸水素ナトリウム (NaHCO3)は、 水 に入れるとNa(ナトリウムイオン)と HCO3-(重炭酸イオン) に電離し、 重炭酸イオン はさらに 水素イオン と反応して水と二酸化炭素になります。 この反応は行ったり来たりしながら、 水溶液のpHを変動させます 。



炭酸水素ナトリウム 炭酸水素ナトリウム価格 炭酸水素ナトリウム応用 Foodchem



Jst Go Jp
高校化学の粒子の数の求め方について。 問題 粒子の数を求めよ 炭酸ナトリウム53g中のナトリウムイオン 答えが60×10^23個になっていますが私がやるとどうしてもそうはなりませんどなたか解説よろしくお願いいたします Na=23 C=12 O=16原因が「重炭酸イオンhco3-が体の中に溜まりすぎてしまった場合」の疾患 重炭酸ナトリウムhco3-の過剰投与、大量輸血、利尿剤の投与 原因が「水素イオンh+が失われすぎてしまった場合」の疾患 大量嘔吐 血液検査データ水素イオン濃度調整剤 表示名等 当該添加物の使用に際し、表示に使える名称 「炭酸水素ナトリウム」「重炭酸ナトリウム」「重炭酸ソーダ」「炭酸水素Na」「重炭酸Na」「重曹」 当該添加物の使用に際し、表示に使える一括名 「かんすい」、「pH調整剤」、「膨張剤」 当該添加物の使用に
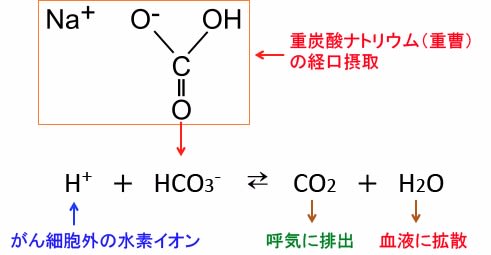



666 がんのアルカリ療法 その3 重曹 重炭酸ナトリウム とトリス塩基 漢方がん治療 を考える
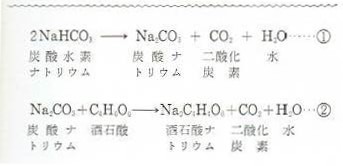



炭酸水素ナトリウムの製法 性質 用途とは わかりやすく解説 わかりやすく解説 科学をわかりやすく解説
このイオン を重炭酸イオン(じゅうたんさんいおん、bicarbonate)と呼ぶこともある。例えば、NaHCO 3 は「炭酸水素ナトリウム」または「重炭酸ナトリウム」と呼ばれる。 天然には主に硬水中に存在し、海水中にも014g dm −3 、mol dm −3 と比較的豊富に存在する。 主な炭酸水素塩炭酸水素ナトリウム(重曹)は化学式nahco 3 であらわされる化合物で、体内でna とhco 3に解離する。 hco 3は重炭酸イオンと呼ばれ、酸を中和し体液をアルカリ性に傾ける働きを示す。 健常状態においてヒトの血液は酸塩基平衡といって肺や腎臓の働きによる血中のh (水素イオン)を体外へ 炭酸水素Naは、水溶液中で有機酸と反応することで炭酸とナトリウムイオンとなり、炭酸はすぐに二酸化炭素ガスとして発泡することから、炭酸水素Naと有機酸 (∗2) の組み合わせで炭酸をコンセプトとした洗顔料、クレンジング製品、シート製品、ゲルパック製品、エアゾール製品、入浴剤などに使用されています 。



2
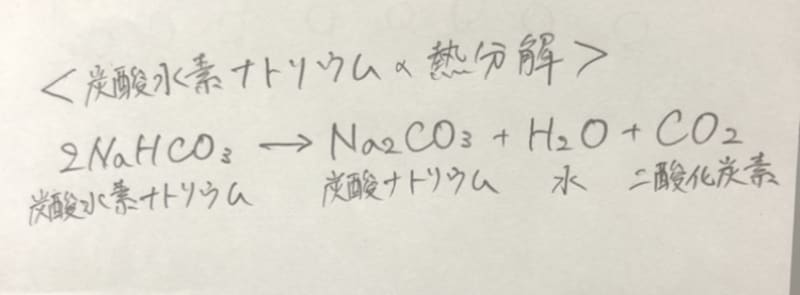



炭酸水素ナトリウムの化学反応式を教えてください アンサーズ
(1)溶 離液は,3mM炭 酸水素ナトリウムと25mM 炭酸ナトリウムを水素イオン濃度64の 蒸留水で希釈 し,11の 混合溶液として用いたこ の溶離液の水素イ オン濃度は実測の結果99で あったが,全 炭酸存在比 から不解離炭酸,炭 酸水素イオソ及び炭酸イオンの濃度炭酸水素ナトリウム nahco 3 カルシウム ca co ナトリウムイオン マグネシウムイオン アルミニウムイオン 硫化物イオン 塩化物イオン 4 k+ ca2 カリウムイオン カルシウムイオン ag+ zn2 2 so 4 - oh- 銀イオン 亜鉛イオン 硫酸イオン 水酸化物イオン nh 4 + cu2 2 co 3 - no 3- アンモニウムイオン




保存版 重曹水を飲むとどんな効果があるの ウォーターサーバー ピュアハワイアン のwebマガジン




トウヤク 炭酸水素ナトリウム 4kg Nobhillmusic Com



中2 理科1 炭酸水素ナトリウムの熱分解 成城中学校 高等学校




炭酸水素ナトリウムとうすい塩酸を混ぜ合わせると何という気体が発生するか物質名 Clearnote
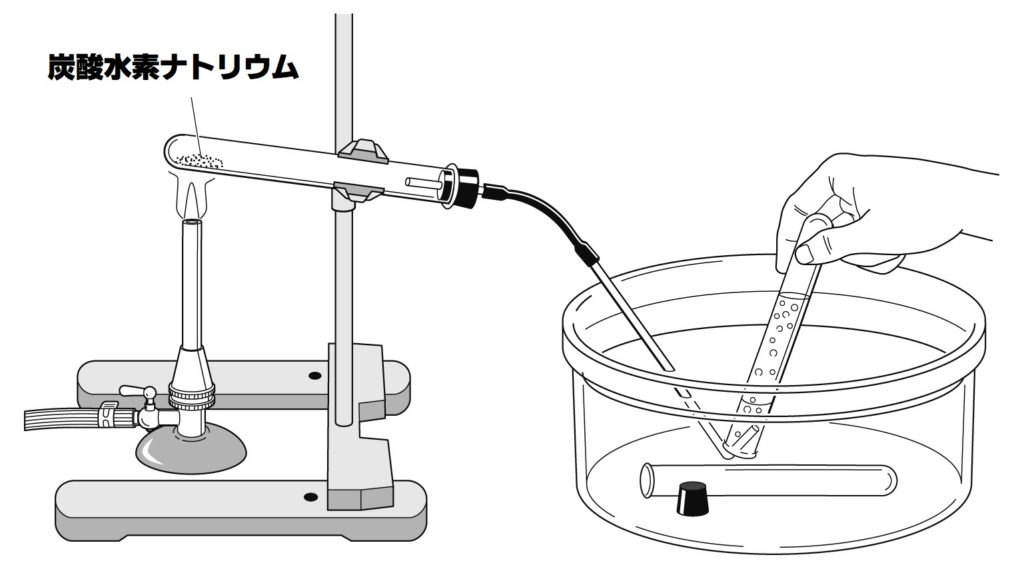



中2理科 炭酸水素ナトリウムの熱分解の定期テスト対策問題 Examee



炭酸水素ナトリウム静注7 np の添付文書 医薬情報qlifepro




例の炭酸水素ナトリウムとカルボン酸どっちが弱酸の塩で どっちが強酸ですか Clearnote




化学 酸性塩の水溶液 オンライン無料塾 ターンナップ




炭酸水素ナトリウム静注7 pl イセイ の添付文書 医薬情報qlifepro




2 2 3 電離平衡



1




炭酸水素ナトリウムの添付文書 医薬情報qlifepro




アスクル 日本薬局方 炭酸水素ナトリウム 500g 健栄製薬 第3類医薬品 通販 Askul 公式




胃酸過多 胸やけ 胃部不快感 胃部膨満感 安心の定価販売 もたれ 胃重 胸つかえ げっぷ はきけ 1個 第3類医薬品 送料込 炭酸水素ナトリウム 3g 12包



炭酸水の作り方 クエン酸 重曹 究建築研究室 Q Labo




完全版 重曹の使い方マニュアル 重曹の活用法はこんなに 掃除 洗濯 消臭まで カジタク イオングループ




炭酸水素ナトリウム Wikipedia




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




炭酸水素ナトリウムの製法 性質 用途とは わかりやすく解説 わかりやすく解説 科学をわかりやすく解説



炭酸水素ナトリウムの分解を化学反応式で教えてください 写真の黄色 Yahoo 知恵袋
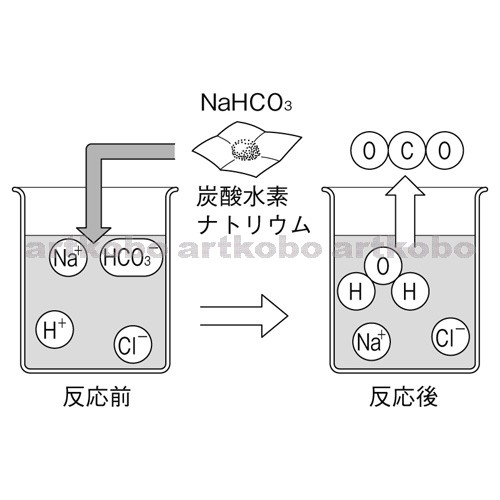



Web教材イラスト図版工房 理 18 滋賀 問 02 05




中2理科 炭酸水素ナトリウムの分解 練習編 映像授業のtry It トライイット



化学基礎で質問です 下の化学反応式について 炭酸水素ナトリウムが8 4gだった Yahoo 知恵袋



炭酸水素ナトリウム




理科とか苦手で 物質の成り立ち01 物質の分解1 炭酸水素ナトリウムの熱分解




オムニ7 イトーヨーカドー ネット通販 日本薬局方 炭酸水素ナトリウム 3g 12包 通販



重曹 クエン酸 炭酸水 ひらけごま
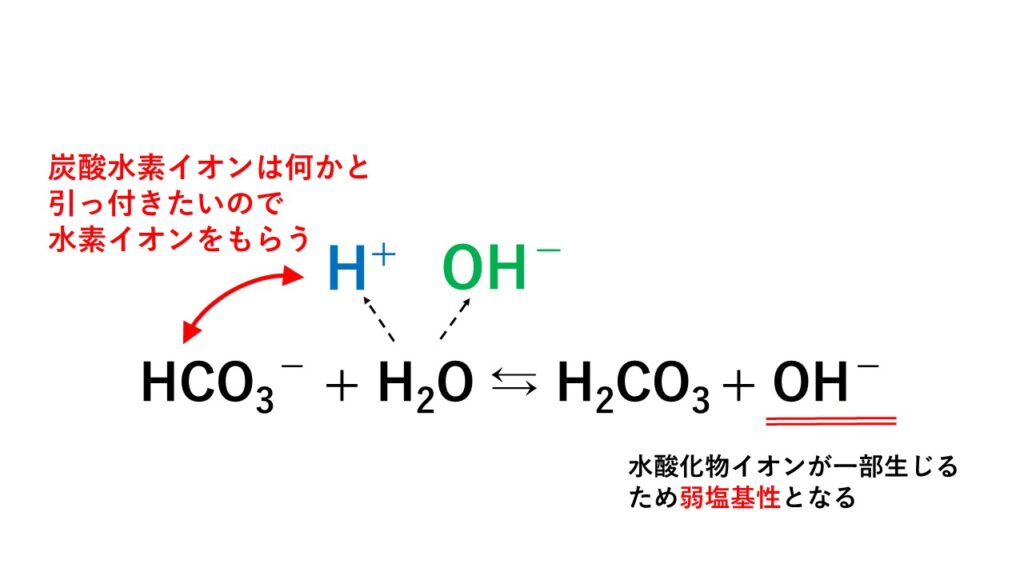



5分でわかる 塩の加水分解と塩の種類と分類 液性を解説 サイエンスストック 高校化学をアニメーションで理解する




炭酸水素ナトリウムを水に溶かした際に生じる炭酸イオンの濃度は 次の 化学 教えて Goo



授業 炭酸水素ナトリウムの熱分解 私の 理科教師日記




胃酸過多 胸やけ 胃部不快感 胃部膨満感 安心の定価販売 もたれ 胃重 胸つかえ げっぷ はきけ 1個 第3類医薬品 送料込 炭酸水素ナトリウム 3g 12包



炭酸水素ナトリウム 炭酸水素ナトリウム価格 炭酸水素ナトリウム応用 Foodchem
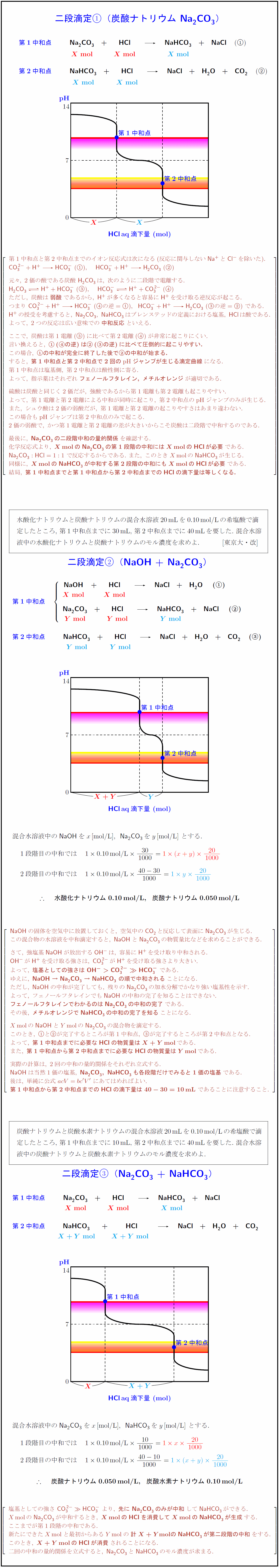



高校理論化学 二段滴定 炭酸ナトリウムna Co Naoh Na Co Na Co Nahco 受験の月




重炭酸塩の陰イオン 化学構造 共通塩は 炭酸水素ナトリウム 重曹 重炭酸アンモニウムを含んでください 骨格式 の写真素材 画像素材 Image 09



炭酸水素ナトリウム You Iggy




国際ブランド 薬用ホットタブプロ 90錠 2袋セット 医薬部外品 重炭酸湯 薬用重炭酸湯 Hot Tab ホットタブpro 90錠 送料無料 株式会社ホットアルバム炭酸泉タブレット正規品 あす楽対応 最終値下 Highseas Com Sa



重曹 製品 サービス情報 Agc化学品カンパニー




至急です この足し算の意味がいまいち分かりません 教えてください Clearnote




14 号 変色麺の製造方法及び変色麺 Astamuse




製菓によく使われるベーキングパウダーの主な成分は 重層 炭酸水素ナトリウム です 最近の研究によると 炭酸水素ナトリウムや炭酸水素カリウムなどの炭酸水素 塩 天然にも多く見られる酸性塩の一種 の分解物である 炭酸水素イオン が どうやら長寿と大きな関係が



中2化学 炭酸水素ナトリウムの熱分解 理科が苦手な者です かなり苦労して熱分 Yahoo 知恵袋




重炭酸塩の陰イオン 化学構造 共通塩は 炭酸水素ナトリウム 重曹 重炭酸アンモニウムを含んでください 骨格式 の写真素材 画像素材 Image 0926



1
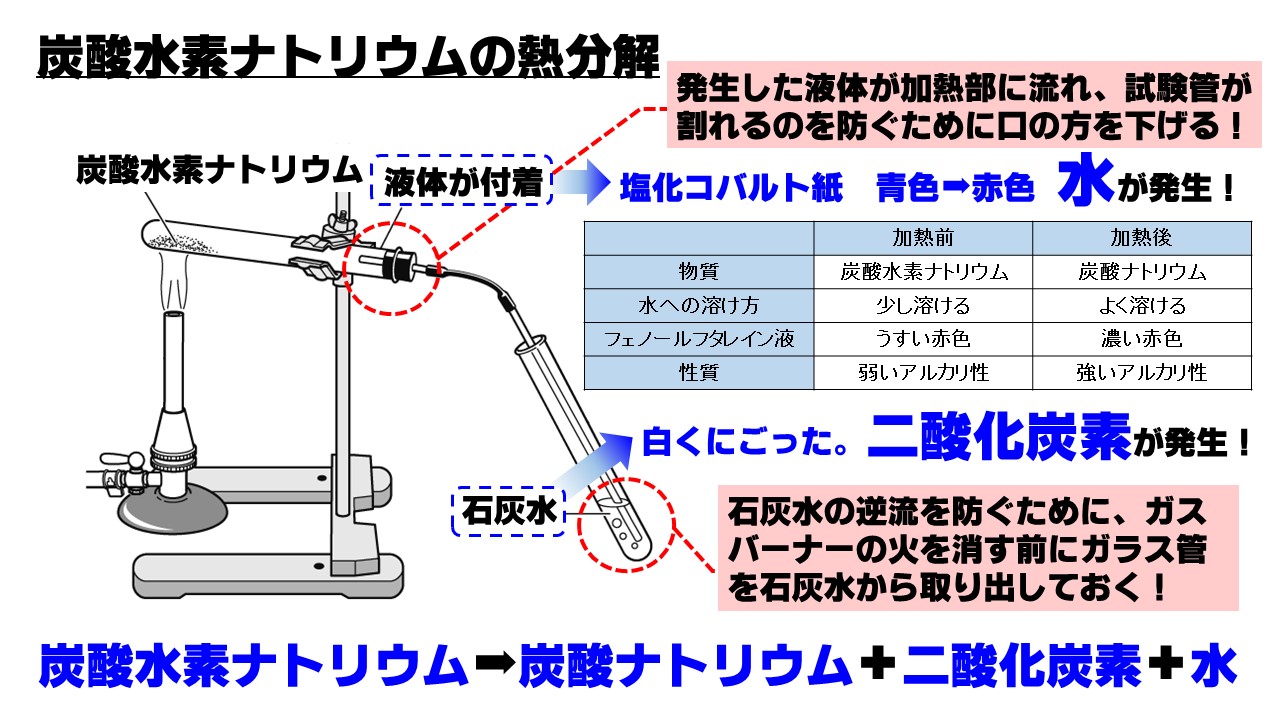



中2理科 炭酸水素ナトリウムの熱分解のポイント Examee




炭酸水素塩 Wikiwand




アスクル 林純薬工業 炭酸水素ナトリウム 特級 500g Cas No 144 55 8 1本 2 3127 25 直送品 通販 Askul 公式



3回生実験のこと 実験の基礎4 3
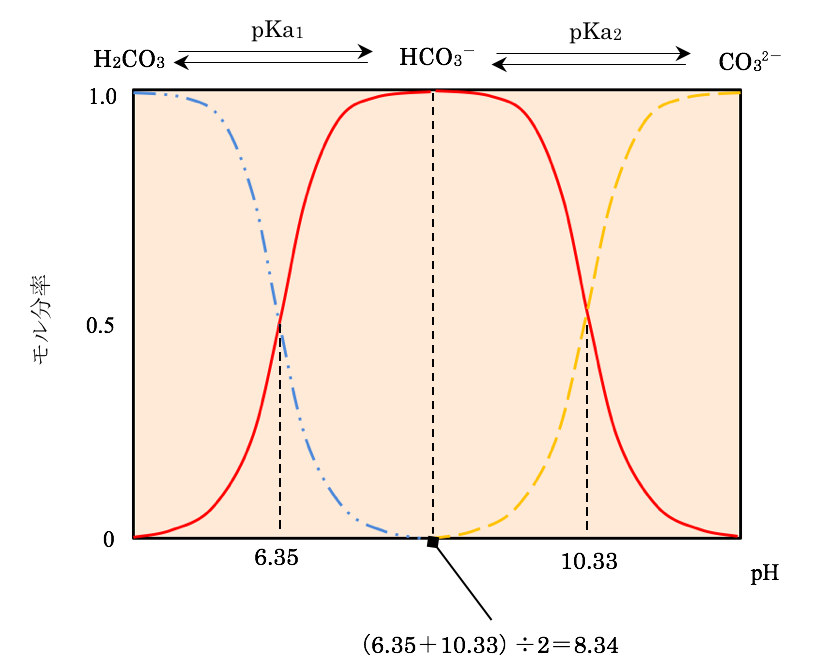



Phの測定 溶液のph Yakugaku Lab




炭酸水素ナトリウムの分解の化学反応式はこうやって覚えよう 塾長の独り言




第4話 溶離液組成による分離の調節 ご隠居達のic四方山話 よもやまばなし シーズン3 メトローム



2
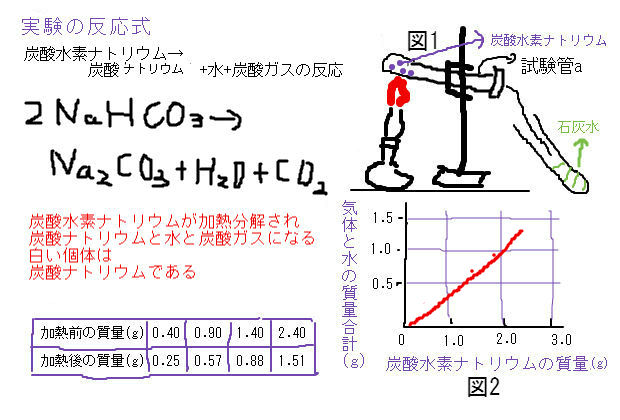



炭酸水素ナトリウムの加熱分解と質量保存のやっかいな問題 中学数学 理科 寺子屋塾の復習サイト



今年の夏の自由研究 紫ケーキが作れるベーキングパウダーを探そう 晴れ ときどき手作り 楽天ブログ




補講 炭酸の平衡 炭酸水素ナトリウムのph Youtube
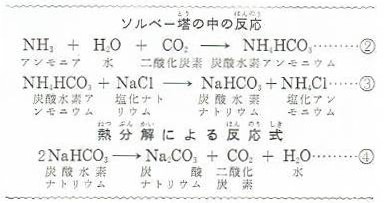



炭酸ナトリウムの製法とは わかりやすく解説 科学をわかりやすく解説




炭酸ナトリウム Wikipedia




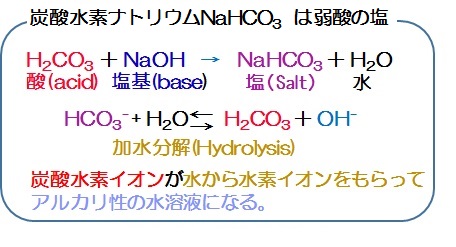
炭酸水素ナトリウムはなぜアルカリ性を示すのか 反応式を使ってわかりやすく解説 ジグザグ科学 Com



Ph曲線とアルカリ度 水浄化フォーラム 科学と技術




本当に知らなきゃ損なのか 重曹の活用法を化学的に考察してみる Reasonable Way Of Life




おそうじ用重曹 イオンのプライベートブランド Topvalu トップバリュ イオンのプライベートブランド Topvalu トップバリュ




中2化学 分解 中学理科 ポイントまとめと整理




高校化学 芳香族化合物の分離の基本 映像授業のtry It トライイット
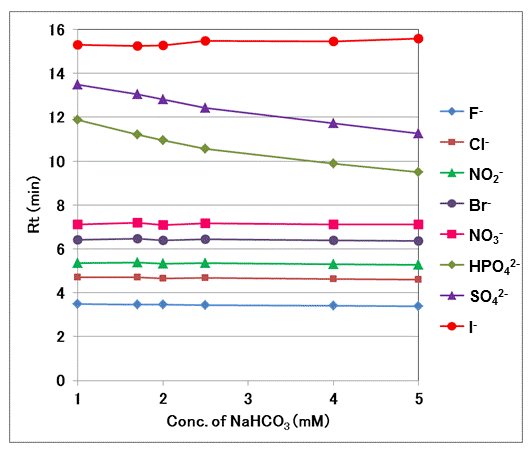



溶出時間の炭酸水素ナトリウム濃度依存性 Si 90 4e Shodex Hplc カラム 装置 標準サンプル




なぜクエン酸は酸性で 重曹はアルカリ性なのか 両者の意外な関係とは 日本霜降社




史上最も激安 薬用 ホットタブ 30錠 3袋 セット 炭酸 入浴剤 冷え対策 冷え性 疲労回復 半身浴 肩のこり 血流促進 代謝アップ 肌荒れ対策 温浴効果 予約販売品 Olsonesq Com




なぜ 炭酸水素ナトリウムは分子をつくる物質ではないのでしょうか Clearnote




二段滴定 原理 例題 計算問題の解き方など 化学のグルメ



炭酸水素ナトリウム 炭酸水素ナトリウム価格 炭酸水素ナトリウム応用 Foodchem




炭酸水素ナトリウム Wikipedia




144 55 8 炭酸水素ナトリウム Sodium Hydrogen Carbonate 195 197 197 199 191 詳細情報 分析 常用試薬 ラボウェア 試薬 富士フイルム和光純薬
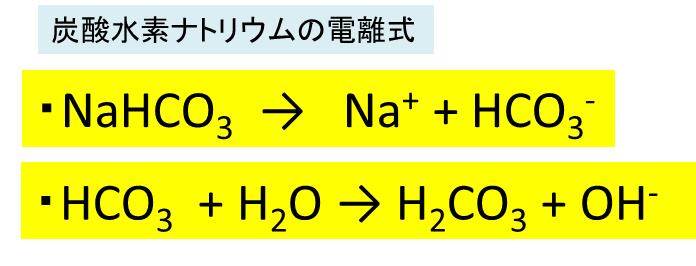



炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



太秦教室 炭酸水素ナトリウムの分解がどうしてもわからない君へ 個別指導塾のyou 学舎日記 公式ブログ




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット



炭酸水素ナトリウムは何が結合しているのですか co2na oh Yahoo 知恵袋




炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法




炭酸水素ナトリウム Wikiwand




炭酸水素ナトリウムの分解の化学反応式はこうやって覚えよう 塾長の独り言




炭酸水素ナトリウムの熱分解 中学理科 By かたくり工務店 マナペディア




炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



3




炭酸ナトリウム Na2co3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法




炭酸水素ナトリウムの化学反応式を教えてください Clearnote




Amazon タイヨー 食添 炭酸水素ナトリウム 500g 大洋製薬 マルチクリーナー




軽 国産 重曹 重炭酸ナトリウム 炭酸水素ナトリウム グレード 食品添加物 25kg アルカリ 食品添加物 有機酸 たまごや商店




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




重炭酸塩の陰イオン 化学構造 共通塩は 炭酸水素ナトリウム 重曹 重炭酸アンモニウムを含んでください 3 D レンダリング 原子は従来色の球体として表されます 水素 白 炭素 灰色 酸素 赤 の写真素材 画像素材 Image




楽天市場 液体薬用歯みがき ペルデンティ デンタルリンス 300ml メール便不可 オーラルケアのdod




中2 化学 3 1 炭酸水素ナトリウム 塩酸 Youtube




炭酸水素ナトリウム Wikipedia




144 55 8 炭酸水素ナトリウム Sodium Bicarbonate 199 詳細情報 分析 試薬 富士フイルム和光純薬
コメント
コメントを投稿